Bicarbonato de sodio
| |||||
| Nombre (IUPAC) sistemático | |||||
|---|---|---|---|---|---|
| Carbonato ácido de sodio | |||||
| General | |||||
| Otros nombres | Bicarbonato de sodio Hidrogenocarbonato de sodio | ||||
| Fórmula semidesarrollada | NaHCO3 | ||||
| Fórmula molecular | n/d | ||||
| Identificadores | |||||
| Número CAS | 144-55-8 | ||||
| Propiedades físicas | |||||
| Estado de agregación | Sólido | ||||
| Apariencia | blanco cristalino | ||||
| Densidad | 2173 kg/m3; 2,173 g/cm3 | ||||
| Masa molar | 84,0 g/mol | ||||
| Punto de fusión | 323,15 K (50 °C) | ||||
| Punto de ebullición | K (-273,15 °C) | ||||
| Punto de descomposición | 543,15 K ( °C) | ||||
| Índice de refracción | 1,3344 | ||||
| Propiedades químicas | |||||
| Solubilidad enagua | 10,3 g/100 g de H2O | ||||
| Termoquímica | |||||
| ΔfH0sólido | -951 kJ/mol | ||||
| S0sólido | 102 J·mol-1·K-1 | ||||
| Riesgos | |||||
| HSci - Safety data | |||||
| Ingestión | No peligroso excepto en cantidades muy grandes | ||||
| Inhalación | Puede causar irritación | ||||
| Piel | Puede causar irritación | ||||
| Ojos | Puede causar ceguera | ||||
| LD50 | 4220 mg/kg | ||||
| Más información | Hazardous Chemical Database(en inglés) | ||||
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. Exenciones y referencias | |||||
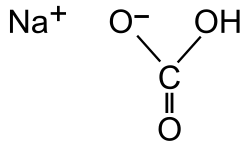
El bicarbonato ohidrogenocarbonato de sodio o carbonato ácido de sodio) es un compuesto sólido cristalino de color blanco muy soluble en agua, con un ligero sabor alcalinoparecido al del carbonato de sodio, de fórmula Na(sodio)HCO3. Se puede encontrar como mineral en la naturaleza o se puede producir artificialmente.
Cuando se expone a un ácido moderadamente fuerte se descompone en dióxido de carbono y agua. La reacción es la siguiente:
- NaHCO3 + HCl → NaCl + H2O + CO2 (gas)
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2 (gas)
- CO2: El óxido de carbono (IV), también denominado dióxido de carbono, gas carbónico y anhídrido carbónico
Debido a la capacidad del bicarbonato de sodio de liberar dióxido de carbono se usa junto con compuestos acídicos como aditivo leudante en panadería y en la producción de gaseosas. Algunas levaduras panarias contienen bicarbonato de sodio. Antiguamente se usaba como fuente de dióxido de carbono para la gaseosaCoca Cola.
Es el componente fundamental de los polvos extintores de incendios o polvo BC.

No hay comentarios:
Publicar un comentario